โดยทั่วไปไฟฟ้าเกิดขึ้นได้หลายวิธีด้วยกัน แต่วิธีที่สำคัญซึ่งทำให้เกิดไฟฟ้าได้นั้น พอจะสรุปได้ดังนี้
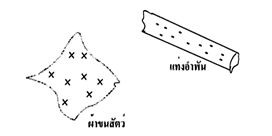
1. ไฟฟ้าที่เกิดจากการขัดสี เกิดจากการที่วัตถุสองชนิดที่แตกต่างกันมาขัดสีกัน ทำให้วัตถุชนิดหนึ่งเสียอิเล็กตรอน ให้แก่วัตถุอีกชนิดหนึ่ง วัตถุที่เสียอิเล็กตรอนจะมีประจุไฟฟ้า เป็นบวก วัตถุที่ได้รับอิเล็กตรอนเพิ่มขึ้นจะมีประจุไฟฟ้าลบ ไฟฟ้าเกิดจากการขัดสีนี้เรียกว่า ไฟฟ้าสถิต วัตถุที่นำมาขัดสีให้เกิดประจุไฟฟ้าได้ง่าย เช่น แท่งแก้ว แท่งอำพัน แท่งยางแข็ง ผ้าไหม ผ้าขนสัตว์ ผ้าแพร เป็นต้น
ตัวอย่างไฟฟ้าที่เกิดขึ้นจากการขัดสี ตามปรากฏการณ์ธรรมชาติได้แก่ ก้อนเมฆกับอากาศ ก้อนเมฆได้รับอิเล็กตรอนจากอากาศและสะสมไว้มากๆ อิเล็กตรอนจึงหาทางถ่ายเทไปให้ก้อนเมฆอื่นๆ ขณะถ่ายเทจะทำให้เห็นเป็นฟ้าแลบเกิดขึ้น หากอิเล็กตรอนถ่ายเทให้กับพื้นดินก็จะทำให้เกิดฟ้าผ่า และถ้าอิเล็กตรอนที่ถ่ายเทจากก้อนเมฆผ่านลงมาถูกคน สัตว์ ต้นไม้ อาคาร หรือสถานที่ก็จะทำให้เกิดอันตรายแก่สิ่งที่อิเล็กตรอนนั้นผ่านได้
2. ไฟฟ้าที่เกิดจากปฏิกิริยาเคมี ได้มาจากการทดลองที่เรียกว่า วอลเทอิกเซลล์ ซึ่งประกอบด้วย แท่งทองแดงกับสังกะสีจุ่มลงในกรดกำมะถัน หรือกรดซัลฟิวริก ซึ่งใช้เป็นสารละลายอิเล็กโทรไลต์ โลหะสองชนิดนี้จะทำปฏิกิริยาเคมีกับกรดกำมะถัน เกิดไฟฟ้าขึ้นซึ่งเป็นกระแสตรง โดยมีสังกะสีเป็นขั้วลบและทองแดงเป็นขั้วบวก สามารถนำไปทดลองกับ หลอดไฟฟ้าเล็กๆ ซึ่งจะทำให้หลอดไฟติดได้ ต่อมาภายหลังวิวัฒนาการมาเป็นเซลล์แห้ง (ถ่านไฟฉาย ) กับ (แบตเตอรี่)
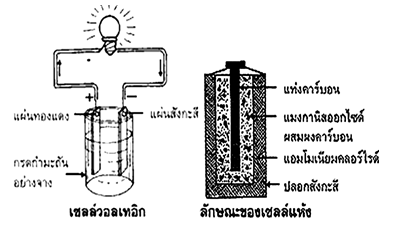
2.1 เซลล์แห้ง (Dry Cell ) ประกอบด้วยกระป๋องสังกะสีซึ่งใช้เป็นขั้วลบ และมีแท่งคาร์บอนอยู่กลางซึ่งเป็นขั้วบวกส่วนสารละลายอิเล็กโทรไลต์จะใช้สารละลายของแอมโมเนียคลอไรด์ผสมแมงกานีสไดออกไชด์ ที่ก้นกระป๋องจะมียางมะตอยกับยาง กั้นไม่ให้แท่งคาร์บอนแตะกับก้นกระป๋อง ส่วนด้านบน ใส่ขี้เลื่อยหรือยางมะตอยแล้วปิดฝาครอบแท่งคาร์บอน เมื่อใช้เซลล์แห้งจนหมดกระป๋องแสดงว่าสังกะสีกับอิเล็กโทรไลต์ จะทำปฏิกิริยากันจนหมดไม่สามารถจะทำให้เกิดปฏิกิริยาได้อีกจึงไม่มีไฟฟ้าเกิดขึ้น ดังนั้น เซลล์แห้งจึงมีช่วงเวลาการใช้งานได้น้อย
2.2 เซลล์ปฐมภูมิ (Primary Cell) จากการทดลองของวอลตา นักวิทยาศาสตร์ชาวอิตาเลียนพบว่า เมื่อนำโลหะสองชนิดที่แตกต่างกัน เช่น สังกะสีกับทองแดงจุ่มลงในสารละลายอิเล็กโทรไลต์ โดยเล็กตรอน(ประจุลบ) จากทองแดงจะถูกดูดเข้าไปยังขั้วของสังกะสี เมื่อทองแดงขาดประจุลบจะเปลี่ยนความต่างศักย์ไฟฟ้าเป็นบวกทันที เรียกว่าขั้วบวก ส่วนสังกะสีจะเป็นขั้วลบตามความต่างศักย์ที่ปรากฏ ถ้าต่อวงจรไฟฟ้า ให้ครบวงจร การถ่ายเทอิเล็กตรอนก็จะเกิดขึ้น ซึ่งเรียกว่ามีการไหลของกระแสไฟฟ้านั่นเอง และถ้าปล่อยให้มีการไหลของกระแสไฟฟ้าเกิดขึ้นเช่นนั้นเรื่อยๆ จะปรากฏว่าแท่งสังกะสีที่ เป็นขั้วลบจะเกิดการสึกกร่อนไปที่ละน้อย ส่วนที่แท่งทองแดงที่เป็นขั้วบวกจะมีฟองก๊าซอยู่รอบ ๆ และการทำงานนี้จะไม่เกิดขึ้นอีกต่อไป ไม่สามารถจะจ่ายกระแสไฟฟ้าออกมาได้ เราเรียกวงจรแบบนี้ว่าเซลล์ตาย (Dead Cell) หรือ เซลล์ปฐมภูมิ (Primary Cell) นั่นเอง
2.3 เซลล์ทุติยภูมิ (Secondary Cell) เป็นเซลล์ที่เมื่อใช้ไฟหมดแล้วสามารถอัดไฟได้ใหม่ โดยทั่วไปจะมีพื้นที่ที่เป็นแผ่นโลหะขนาดใหญ่ เพื่อทำให้ปฏิกิริยาเคมีเกิดขึ้นมากที่สุด ดังนั้นกระแสไฟฟ้าที่เกิดขึ้นก็จะ มากด้วยตามพื้นที่ของโลหะ ระหว่างแผ่นโลหะและแผ่นบวกจะมี ฉนวนกั้น ซึ่งอาจจะเป็นไม้หรือแก้วพรุนเพื่อให้สารละลายอิเล็กโทรไลต์ผ่านไปได้ ขั้วบวกและขั้วลบจะต่อยืดกับฝายางที่กันกรดได้และยังมีรูสำหรับเติมน้ำกลั่นให้กับสารละลายอิเล็กโทรไลต์ได้อีกด้วย เพราะขณะที่ใช้งานสารละลายอิเล็กโทรไลต์จะระเหยไป นอกจากนี้ยังเป็นทางปล่อย ให้ก๊าซที่เกิดจากแผ่นบวกออกไปสู่ภายนอกได้อีกด้วย
2.4 แบตเตอรี่ (Battery) คือ เซลล์ทุติยภูมิตั้งแต่สองเซลล์ที่มาต่อเข้าด้วยกัน เมื่อใช้ไฟหมดแล้วสามารถอัดไฟใหม่ได้อีกแบตเตอรี่ทั่วไปมักจะใช้เซลล์สามช่องหรือหกช่องต่ออนุกรมกัน แต่ละช่องจะได้ไฟสองโวลต์ เช่น ถ้าต่อ 3 ช่อง ก็ได้ 6 โวลต์ ถ้าต่อ 6 ช่อง ได้ 12 โวลต์ อิเล็กทรอนิกส์จะทำงานได้ต้องอาศัยพลังงานไฟฟ้า เช่น เซลล์หรือแบตเตอรี่ ซึ่งมีขนาดตั้งแต่เท่ากระดุม ที่ใช้กันในกล้องถ่ายรูปและเครื่องช่วยฟัง โดยมีแรงดันประมาณ 1.3 โวลต์ จนถึงขนาดถ้วยแก้วที่ใช้ในห้องทดลอง เซลล์เปียกหรือ แบตเตอรี่จะให้กระแสไฟฟ้าได้สูงกว่าเซลล์แห้ง จึงใช้ได้นานกว่า ด้วยเหตุนี้แบตเตอรี่ในรถยนต์จึงสามารถใช้กับอุปกรณ์ทุกชนิด เช่น พัดลมระบายความร้อน มอเตอร์ปัดน้ำฝน มอเตอร์เร่งหรือมอเตอร์ฉุดหลอดไฟ เป็นต้น แบตเตอรี่รถยนต์เป็นชนิดกรด แต่ยังมีอีกชนิดหนึ่งคือ ชนิดด่าง ซึ่งมีข้อดีบางอย่างที่ดีกว่าชนิดกรด เช่น ไม่กัดแบตเตอรี่และตัวรถแบตเตอรี่ทั้งสองชนิดรวมกัน เรียกว่า แบตเตอรี่เปียก หรือแอคูบูเลเตอร์ เมื่อใช้ไฟหมดแล้วสามารถอัดไฟเข้าไปใหม่ได้
